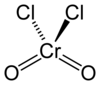
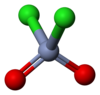
铬酰氯
铬酰氯(英语:Chromyl Chloride)是一种无机化合物,化学式为CrO2Cl2。它是一种暗红色有刺鼻气味的液体,遇水剧烈分解,在空气中发烟。能溶于氯仿、苯、二硫化碳、四氯化碳、三氯氧磷。具强氧化性,是有机合成试剂,也用作溶剂。会腐蚀橡胶和大部分塑料。
| 铬酰氯 | |||
|---|---|---|---|
| |||

| |||
| IUPAC名 Chromium(VI) dichloride dioxide 二氯二氧化铬(VI) | |||
| 别名 | 氧氯化铬、氧化铬氯、氯化铬酰 | ||
| 识别 | |||
| CAS号 | 14977-61-8 | ||
| ChemSpider | 21106426 | ||
| InChI |
| ||
| InChIKey | AHXGRMIPHCAXFP-UHFFFAOYSA-L | ||
| EINECS | 239-056-8 | ||
| ChEBI | 33038 | ||
| RTECS | GB5775000 | ||
| 性质 | |||
| 化学式 | CrO2Cl2 | ||
| 摩尔质量 | 154.9008 g·mol⁻¹ | ||
| 外观 | 深红色发烟液体 | ||
| 密度 | 1.911 g/mL(液) | ||
| 熔点 | -96.5℃ | ||
| 沸点 | 117℃ | ||
| 溶解性(水) | 分解 | ||
| 危险性 | |||
| 警示术语 | R:R8, R35 R43, R46, R49, R50/53 | ||
| 安全术语 | S:S45, S53, S60, S61 | ||
| 相关物质 | |||
| 相关化学品 | 硫酰氯、三氯氧钒、 二氯二氧化钼、 二氯二氧化钨 | ||
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |||
制备
编辑由三氧化铬与氯化氢反应得到。一般用重铬酸钾/铬酸钾与浓盐酸反应,并加入硫酸作脱水剂。反应后的反应液出现分层,密度较大的铬酰氯为下层,用分液或分馏的方法即可分离出来。[1]
铬酰氯也可由重铬酸钾分别与五氯化磷、四氯化钛、氯磺酸或浓硫酸+氯化钠作用得到。[2]
性质
编辑为四面体型分子,铬原子位于中心,为VI氧化态(+6)。氧化性比铬酸根离子更强。具很强的亲电性。
与无定形硫混合发生自燃。遇水迅速发生水解,生成盐酸和铬酸,液体在潮湿空气中发烟。
上文中用浓硫酸、重铬酸钾与氯化物作用制取铬酰氯的反应可用于样品中氯化物的鉴定。若样品与浓硫酸、重铬酸钾混合后共热时,产生红色的铬酰氯烟雾,即可证明样品中氯离子的存在。氟化物、溴化物、碘化物和氰化物对反应均不产生干扰。
铬酰氯可将末端烯烃氧化为醛,将非末端烯烃氧化为α-氯代酮及衍生物,[3]以及将与芳环相连的甲基氧化为醛基(Étard反应)。也称Étard试剂。二氯甲烷是常用的反应溶剂。此类型的有机合成试剂还有三氯氧钒、四氯化钛及硫酰氯。
危险性
编辑主要通过吸入的方式进入人体,具强致癌性,[4]会导致染色体异常,长期与皮肤接触会导致皮肤溃疡。[5]
对眼睛、皮肤、呼吸道和粘膜具强烈刺激作用,急性吸入可能因支气管和咽喉的痉挛、炎症、水肿、化学性肺炎、肺水肿而致死。[5]
参考资料
编辑- ^ Sisler, H. H. "Chromyl Chloride" Inorganic Synthesis McGraw-Hill: New York, 1946; Vol. 2, pp 205–207.
- ^ Moody, B.J. 22. Comparative Inorganic Chemistry 1. London: Edward Arnold. : 381 [1965] (英语).
- ^ F. Freeman, R. H. DuBois, T. G. McLaughlin. "Aldehydes by Oxidation of Terminal Olefins with Chromyl Chloride: 2,4,4-Trimethylpentanal". Org. Synth.; Coll. Vol. 6: 1028.
- ^ IARC. Volume 49: Chromium, Nickel, and Welding (PDF). 1999-11-05: 21–23 [1990] [2008-03-26]. ISBN 92-832-1249-5. (原始内容 (PDF)存档于2008-12-24).
- ^ 5.0 5.1 Prof CH Gray (编). IV. Laboratory Handbook of Toxic Agents 2. London: Royal Institute of Chemistry. : 79 [1966] (英语).
- F. Freeman "Chromyl Chloride" in Encyclopedia of Reagents for Organic Synthesis (Ed: L. Paquette) 2004, J. Wiley & Sons, New York. DOI: 10.1002/047084289.