碳氧鎓離子
碳氧鎓離子(或氧碳鎓離子)是一類在中心sp2-雜化的碳原子上連有氧取代基,並且能夠在中心碳原子和氧原子之間通過π鍵離域分散所攜帶的正電荷的化學物種。 [1] 碳氧鎓離子可以用兩個共振極限結構表示,一個是碳正離子形式,另一個是滿足8電子規則且氧帶形式電荷的氧鎓形式。 真實結構為共振雜化體,介於兩者之間。碳氧鎓離子與酮或酯等中性羰基化合物相比,碳正離子形式的共振式對共振雜化體的結構的貢獻更大。碳氧鎓離子是糖苷鍵水解中常見的反應性中間體,並且是糖基化合成的常用策略。 這些離子作為多種化學反應中的活性中間體,已在有機合成中得到廣泛應用,且已成功用於幾種天然產物的全合成中。 此外,它們通常在自然界中以酶催化下的生物化學合成和碳水化合物水解的機理出現。 花青素是天然的黃酮染料,是穩定的氧碳鎓化合物。 花色苷是造成多種常見花(例如紫羅蘭)和食用植物(例如茄子和藍莓)顯現顏色的原因。
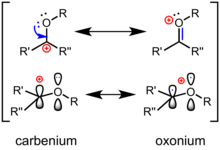
電子分佈和反應性 編輯
氧碳鎓離子的最優共振式包含一個碳氧雙鍵 ,該氧原子與另一個基團相連,因此帶有形式正電荷。 經典價鍵理論(或「共振式」)認為,π鍵的極化可以用次穩定的共振式描述,碳周圍有六個電子且攜帶形式正電荷(見上文)。 根據前線分子軌道理論 ,碳氧鎓離子的最低未佔據分子軌道 (LUMO)是π *軌道,在碳原子上具有較大波瓣。電負性較高的氧對LUMO的貢獻相對較小。 因此,在發生親核進攻時 ,碳是親電位點 。 與酮相比,碳氧鎓離子雙鍵的極化作用更加突出:它們更像「真正的」碳正離子,並且對親核試劑更具反應性。 在有機反應中,通常通過路易斯酸或布朗斯台德酸與氧的配位來活化酮,生成氧碳鎓離子中間體。
在數值上,酮R2C=O(如丙酮)的羰基碳所攜帶的的典型部分電荷為δ+ = 0.51(源自Hartree-Fock計算)。而當酮的氧原子質子化後產生[R2C=OH]+ 物種,部分電荷增加至δ+ = 0.61。 相比之下,酮和碳氧鎓離子的氮取代類似物,亞胺(R2C=NR)和亞胺鎓離子([R2C=NRH]+)的部分電荷分別為δ+ = 0.33和δ+ = 0.54 。因此,羰基碳所攜帶的部分正電荷大小的順序為亞胺<酮<亞胺鎓<碳氧鎓。
這也是包含 C=X (X = O, NR)鍵的物種的親電性的順序。 這個順序在有機合成中得到了應用和解釋,例如:為什麼還原胺化通常最好在pH= 5至6時進行,這個反應用到了 氰基硼氫化鈉 (Na+[H3B(CN)]−) 或三乙酰氧基氫化硼鈉(Na+[HB(OAc)3]−)作還原劑。 帶有吸電子基團的氰基硼氫化鈉和三乙酰氧基硼氫化鈉比硼氫化鈉還原能力弱,它們與酮的直接反應通常是一個緩慢而低效的過程。 但是,在還原胺化反應過程中原位形成的亞胺鎓離子(並非是亞胺本身)比酮類原料具有更強的親電性,並且將以在合成中有價值的速率與負氫還原劑反應。 重要的是,該反應是一般在弱酸性條件下進行的,此時電中性的亞胺中間體顯著質子化,形成亞胺鎓離子,而在弱酸性環境中,酮並不能夠質子化,親電性依然較弱。 因此,反應條件和試劑確保了在該反應中由亞胺基還原選擇性地形成胺,而不是直接還原羰基(或其質子化形式)以形成醇。
形成 編輯
氧碳鎓離子的形成可以通過幾種不同的途徑進行。 最常見的是:酮的氧原子與路易斯酸配位,從而活化酮,使其成為更有效的親電子試劑。 路易斯酸可以是多種分子或離子,可以是質子或金屬配合物等。 本條目的其餘部分將重點討論烷基氧碳鎓離子。烷基氧碳鎓離子額外連接在羰基氧上的原子是碳。 形成這種離子的一種方式是離去基團的消除,在糖化學中,該離去基團通常是醚或酯 。
合成應用 編輯
五元環 編輯
五元環反應所涉及的立體化學可以通過信封形過渡態模型來預測。 親核試劑有利於從信封的「內部」或右側圖的頂部加成。從信封內部加成將產生有利的交錯式構象,而從信封外加成則將產生能量不利的重疊式構象 。 [2]
六元環 編輯
Woods等人於1992年提出了六元碳氧鎓環的過渡態模型。 [3] 確定六元環的親核加成的立體化學的一般策略與五元環類似。 此分析依據的一種假設是:該環與環己烯具有相同的構象,其中三個碳和一個氧在一個平面內,而另外兩個碳原子一個在該平面上方,另一個在下方(請參閱右圖)。 依據環上存在的取代基,可以確定最低的能量構象,確定時要考慮空間和立體電子效應。 確定了這種構象後,就可以考慮親核加成的立體化學。 加成將通過低能量的椅式過渡狀態進行。可以在下面看到此類反應的示例。 該示例還說明了負電取代基可能會有較明顯的的立體電子效應,通常這會改變最優構象的結構,使得反應的選擇性發生變化。 [4]
立體電子效應 編輯
在不包含氧原子的烯烴環中,任何大的取代基都傾向於位於赤道位置,以使空間效應最小化。 但是在含碳氧鎓離子的環中, 負電性取代基傾向於優先佔據軸向或准軸向位置。 當負電性原子處於軸向位置時,其電子密度可以通過立體電子效應分散給環中帶正電的氧原子。 [5] 這種相互作用穩定了軸向構象。表現出這種現象的取代基的實例主要有 羥基 , 醚和鹵素。 在確定氧代碳鎓離子的親核加成反應中能量最低的構象時,必須考慮立體電子效應 。 [4] [6]
環加成 編輯
在有機合成中,乙烯基氧碳鎓離子(右側結構)可廣泛用於環加成反應中。 它們通常在Diels-Alder反應中用作親二烯體 。 通常將吸電子酮添加到該親二烯體中以提高反應速率, [7]在反應過程中,這些酮經常轉化為乙烯基氧碳鎓離子[8]。目前尚不清楚該機理是否必須經歷碳氧鎓離子中間體,但Roush和他的同事在以下所示的環化反應中證明了該反應確實生成了氧碳鎓離子中間體。 該反應可觀察到的兩種產物只有在氧碳鎓環作為中間體存在時才能形成。已經有人報道氧碳鎓離子中間體參與的[9][4+3], [2+2], [3+2]和[5+2]環加成。
羥醛反應 編輯
已有利用手性氧碳鎓離子與乙烯醇衍生等價物進行高度非對映選擇性和對映選擇性的反應 [10] 氧碳鎓離子在反應中用作親電試劑 。 當甲基替換為更大的取代基時,反應的非對映選擇性增加。
全合成實例 編輯
氧碳鎓離子已在多種場合中用於全合成。(+)-clavosolide的主要亞基是通過還原六元氧碳鎓環合成的。 如所預測的,所有大的取代基都位於赤道位置,並且該轉化經歷了椅式過渡狀態。 [11]
第二個例子可見於 (−)-neopeltolide合成的關鍵步驟,該步驟使用另一種六元氧碳鎓環發生還原反應生成非對映選擇性加氫產物。 [12]
生物學應用 編輯
在生物系統中,氧碳鎓離子最常見於碳水化合物的反應過程中。 由於糖存在於核酸中,它的化學性質對核酸在生物體內的功能起到了重要作用。 糖除了在核酸中發揮生理功能外,還是生物體的結構組分,可以多種形式存在,例如儲能分子、細胞信號分子、蛋白質修飾,並在免疫系統 、 受精作用 、預防發病機制 、血液凝結和發育中發揮關鍵作用。 [13] 生物化學過程中糖化學性質豐富,許多糖參與的反應經歷氧碳鎓離子中間體。 本節概述了利用氧碳鎓離子的幾種重要的生物反應。
核苷酸生物合成 編輯
酶催化下核苷酸的分子內環化可產生幾種重要的生物分子。 這些環化通常通過氧碳鎓中間體進行。 該反應的一個例子是環ADP核糖的環化。 [14]
糖苷酶 編輯
糖苷酶是一種催化糖苷鍵斷裂的酶,它能使底物糖分解產生兩個較小的糖分子 。 這個過程對動物體內糖原等儲能物質的利用以及植食生物進行纖維素的分解具有重要意義。 通常,酶的活性位點上的天冬氨酸或穀氨酸殘基可以催化糖苷鍵的水解。 這些酶的機制涉及氧碳鎓離子中間體,其一般實例如下所示。 [15]
參見 編輯
參考文獻 編輯
- ^ 國際純化學和應用化學聯合會,化學術語概略,第二版。(金皮書)(1997)。在線校正版: (2006–) "carbenium ion"。doi:10.1351/goldbook.C00812
- ^ Larsen, C. H.; Ridgway, B. H.; Shaw, J. T.; Woerpel, K. A., A Stereoelectronic Model to Explain the Highly Stereoselective Reactions of Nucleophiles with Five-Membered-Ring Oxocarbenium Ions, Journal of the American Chemical Society, 1999, 121 (51): 12208–12209, doi:10.1021/ja993349z
- ^ Woods, R. J.; Andrews, C. W.; Bowen, J. P., Molecular mechanical investigations of the properties of oxocarbenium ions. 2. Application to glycoside hydrolysis, Journal of the American Chemical Society, 1992, 114 (3): 859–864, doi:10.1021/ja00029a008
- ^ 4.0 4.1 Romero, J. A. C.; Tabacco, S. A.; Woerpel, K. A., Stereochemical Reversal of Nucleophilic Substitution Reactions Depending upon Substituent: Reactions of Heteroatom-Substituted Six-Membered-Ring Oxocarbenium Ions through Pseudoaxial Conformers, Journal of the American Chemical Society, 1999, 122: 168–169, doi:10.1021/ja993366o
- ^ Miljkovic, M. i.; Yeagley, D.; Deslongchamps, P.; Dory, Y. L., Experimental and Theoretical Evidence of Through-Space Electrostatic Stabilization of the Incipient Oxocarbenium Ion by an Axially Oriented Electronegative Substituent During Glycopyranoside Acetolysis, The Journal of Organic Chemistry, 1997, 62 (22): 7597–7604, doi:10.1021/jo970677d
- ^ Hansen, Thomas; Lebedel, Ludivine; Remmerswaal, Wouter A.; van der Vorm, Stefan; Wander, Dennis P. A.; Somers, Mark; Overkleeft, Herman S.; Filippov, Dmitri V.; Désiré, Jérôme. Defining the SN1 Side of Glycosylation Reactions: Stereoselectivity of Glycopyranosyl Cations. ACS Central Science. 2019-04-18, 5 (5): 781–788. ISSN 2374-7943. doi:10.1021/acscentsci.9b00042.
- ^ Vollhardt; Shore. Organic Chemistry. New York, NY: W. H. Freeman and Co. 2009.
- ^ Harmata, M.; Rashatasakhon, P., Cycloaddition reactions of vinyl oxocarbenium ions, Tetrahedron, 2003, 59 (14): 2371–2395, doi:10.1016/s0040-4020(03)00253-9
- ^ Roush, M.; Gillis, P.; Essenfeld, A., Hydrofluoric acid catalyzed intramolecular Diels–Alder reactions, Journal of Organic Chemistry, 1984, 49 (24): 4674–4682, doi:10.1021/jo00198a018
- ^ Kanwar, S.; Trehan, S., Acetate aldol reactions of chiral oxocarbenium ions, Tetrahedron Letters, 2005, 46 (8): 1329–1332, doi:10.1016/j.tetlet.2004.12.116
- ^ Carrick, J. D.; Jennings, M. P., An Efficient Formal Synthesis of (−)-Clavosolide a Featuring a "Mismatched" Stereoselective Oxocarbenium Reduction, Organic Letters, 2009, 11 (3): 769–772, doi:10.1021/ol8028302
- ^ Martinez-Solorio, D.; Jennings, M. P., Formal Synthesis of (−)-Neopeltolide Featuring a Highly Stereoselective Oxocarbenium Formation/Reduction Sequence, The Journal of Organic Chemistry, 2010, 75 (12): 4095–4104, doi:10.1021/jo100443h
- ^ Maton, Anthea; Jean Hopkins; Charles William McLaughlin; Susan Johnson; Maryanna Quon Warner; David LaHart; Jill D. Wright. Human Biology and Health. Englewood Cliffs, New Jersey, USA: Prentice Hall. 1993: 52–59. ISBN 0-13-981176-1.
- ^ Muller-Steffner, H. M.; Augustin, A.; Schuber, F., Mechanism of Cyclization of Pyridine Nucleotides by Bovine Spleen NAD+ Glycohydrolase, Journal of Biological Chemistry, 1996, 271 (39): 23967–23972, PMID 8798630, doi:10.1074/jbc.271.39.23967
- ^ Zechel, D.L.; Withers, S.G. Glycosidase Mechanisms: Anatomy of a Finely Tuned Catalyst. Accounts of Chemical Research. 2000, 33 (1): 11–18. ISSN 0001-4842. PMID 10639071. doi:10.1021/ar970172.